Életünket lassan egy éve a SARS-CoV-2 – közismertebb nevén a COVID-19 – vírus és mutánsai határozzák meg. Az elmúlt évben kifejlesztettek és ma már engedélyezve vannak olyan vakcinák, amelyekkel beolthatók vagyunk és amelyek védettséget biztosíthatnak a betegség ellen. Magyarországon a COVID-19 vírus ellen védő vakcinák nem kaphatóak gyógyszertári forgalomban, azok beadása népegészségügyi célból ingyenesen kérhető. Kiemelten fontosnak tartjuk, hogy Önöknek, a pácienseinknek, a felelős döntéshez autentikus forrásokból származó információkat ajánljunk.
Elsőként fogalmi kérdéseket tisztázunk. Miért van szükség a védőoltásra, hogy működik? Mi egy oltás „forgalomba hozatalának” feltétele, más szóval mikor ajánlható, felírható, beadható az oltás a pácienseknek Magyarországon? Ebben a kérdésben az uniós tagságnak milyen szerepe van? Vannak-e korhatárt illető, vagy más korlátozó tényezők az alkalmazás kapcsán?
- Milyen betegségek ellen és miért szükséges a védőoltás (vakcina)?
- A védőoltások beadásának, a vakcinációnak a célja - nagyobb populációt veszélyeztető fertőző betegségekkel szembeni védettség biztosítása. Számos példát lehet felhozni. A feketehimlő, a történelem egyik legpusztítóbb fertőzése volt, esetenként több mint 50 %-os halálozási aránnyal, a túlélőknél vakságot okozva. A XVIII. század végén E.Jenner fedezte fel a legyengített vírusokkal való mesterséges fertőzés elvét, - a himlő elleni oltás esetében – amely védettséget váltott ki az emberben ezzel a borzalmas betegséggel szemben. Az 1960-as években még 10 millió áldozatot követelő járványt az érintett területeken történő teljeskörű vakcinációval 1980-ra gyakorlatilag felszámolták.
- Milyen elvek, működési mechanizmus, technológia alapján hatnak a COVID-19 elleni védőoltások?
- A cél az, hogy az ember immunrendszere „felpörögjön”, védekezzen. Rövid összefoglalás a jelenleg ismert vakcinákról.
A koronavírus elleni oltások esetében a gyártás egyrészt az un. klasszikus, másrészt az új - következő - generációs gyártási technológiával történik*.
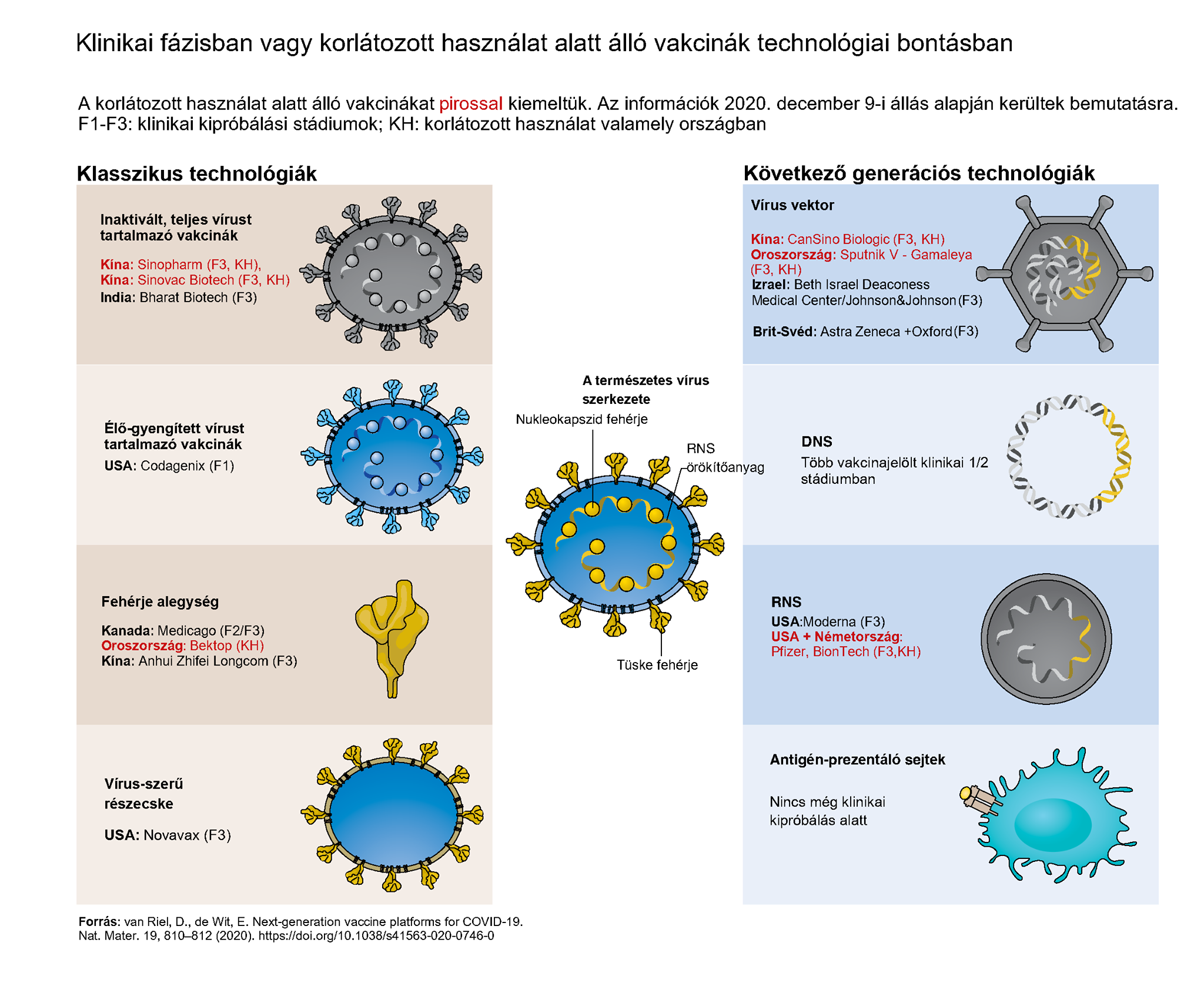 * A fentiek közül Magyarországon 2021.01.30-án a következő vakcinák kerülnek beadásra, illetve várnak alkalmazásra:
* A fentiek közül Magyarországon 2021.01.30-án a következő vakcinák kerülnek beadásra, illetve várnak alkalmazásra:
- EU hatáskörben engedélyezett az új generációs RNS USA+Németország Pfizer, BionTech készítmény,
- feltételes forgalombahozatali engedéllyel a brit+svéd vírus-vektor technológián alapuló Astra-Zeneca COVID-19 Vaccine (ChAdOx1-S),
- nemzeti hatáskörben engedélyezés alatt álló, a vírus vektor alapján előállított Oroszország Sputnik V - Gamaleya készítmény, valamint
- az inaktívált, teljes vírust tartalmazó kínai Sinopharm vakcina.
Az un. klasszikus vakcinák túlnyomó többségét vagy vírus-alapú vagy protein-alapú vakcinák csoportjába lehet sorolni. A vírus alapú vakcinák állhatnak inaktívált vírusból, amely már nem fertőző, vagy élő gyengített vírusból. A fehérjealapú vakcinák állhatnak a vírusból vagy vírussal fertőzött sejtekből tisztított fehérjéből, amelyek az immunrendszer válaszát generálják a vírussal szemben.
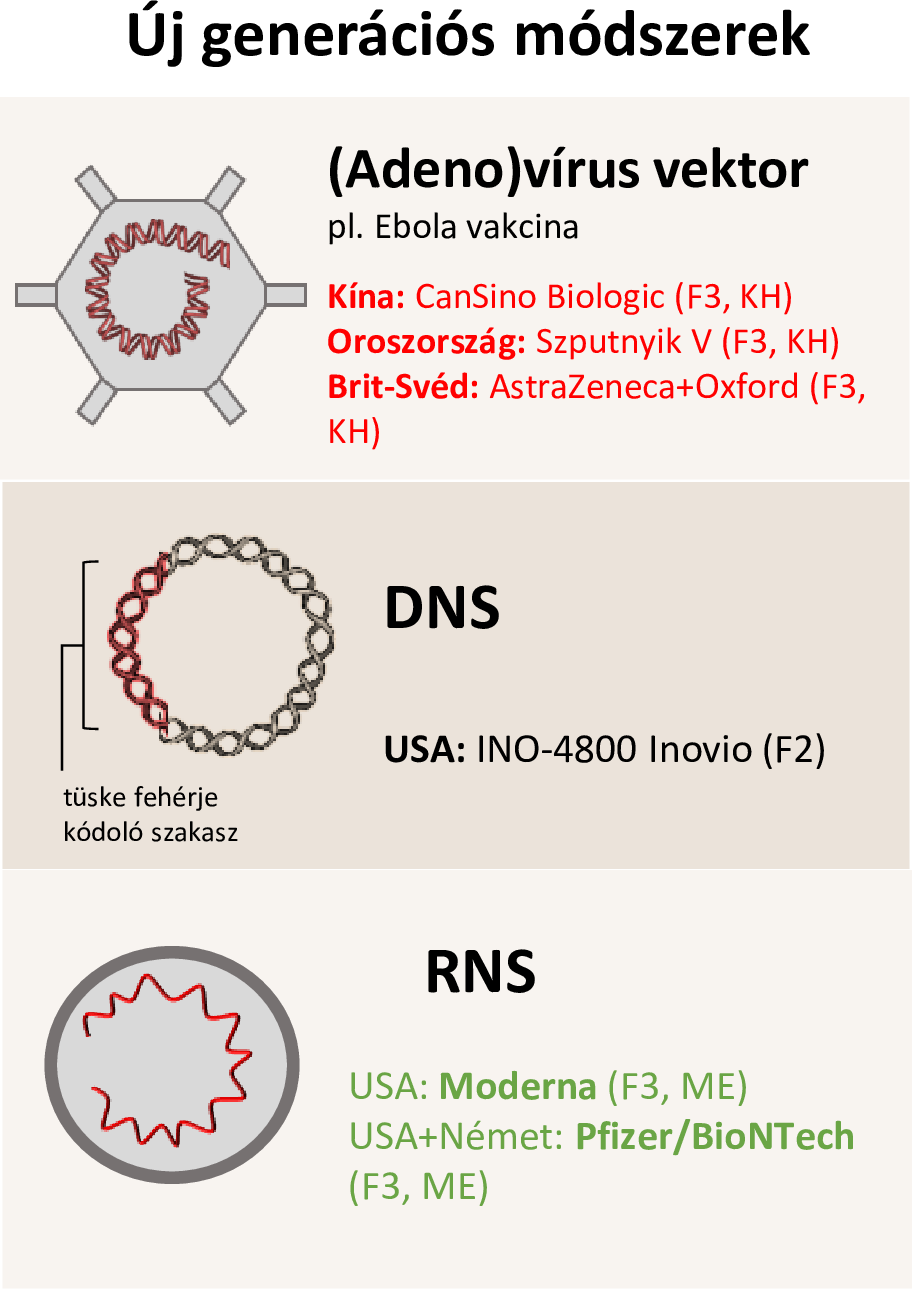
Az új generációs vakcinák esetében a fertőzéssel szembeni immunválaszt az emberi szervezet a fehérje előállításához szükséges kódoló RNS, vagy DNS bejuttatásával oldja meg. A hazai vakcináció ma a tüskefehérjét kódoló mRNS elv alapján hatásos oltóanyagra épül (ld. az ábra RNS sorát): (1)
 |
 |
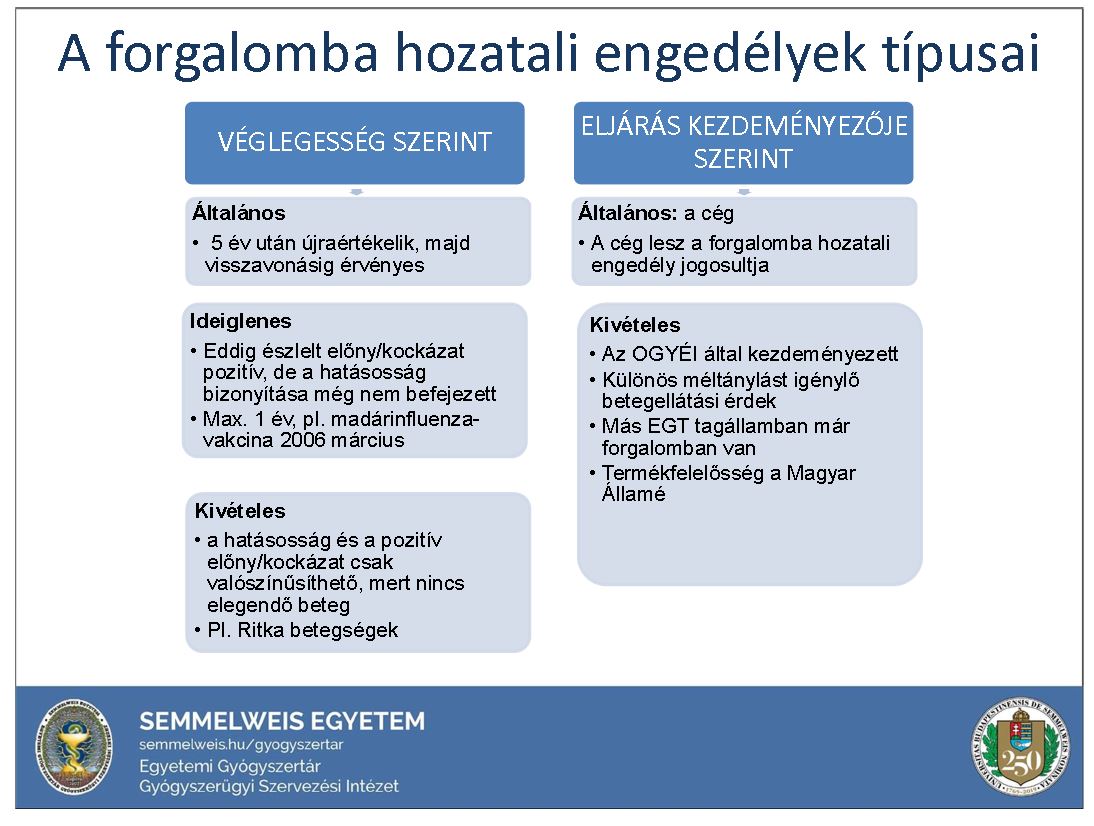
I. Hivatalos engedélyezés – az oltás feltétele!
- Magyarországon mi a feltétele egy vakcina engedélyezésének, „forgalomba hozatalának”, (bár a COVID-19 elleni vakcina esetében nem kereskedelmi forgalomról beszélünk, hiszen az oltás népegészségügyi okból mindenkinek - aki kéri - ingyenes)?
- A gyógyszerek engedélyezése nemzeti szakhatósági hatáskör. Ez azt jelenti, hogy a forgalomba hozatali engedélyezési eljárás során a szakmai hatóság – Magyarországon az OGYÉI Országos gyógyszerészeti és Élelmezés-egészségügyi Intézet – szigorú eljárási rend szerint értékeli az új szer minőségét, relatív ártalmatlanságát és hatásosságát, illetve megfelelés esetén a készítményt államigazgatási határozattal gyógyszerré nyilvánítja. Az Európai Unió gyógyszerek forgalomba hozataláért felelős hatósága az EMA - European Medicines Agency - (Európai Gyógyszer Ügynökség, ill. a CHMP - Committee for Medicinal Products for Human Use – (Gyógyszerügyi Bizottság) (2).
- Milyen szerepe van az Európai Unió gyógyszerügyi hatóságainak a COVID-19 elleni vakcina engedélyezési eljárásában?
- Az Európai Unió országaira érvényes elv az, hogy ha és amennyiben egy készítményt az EU gyógyszerügyi hatóságai engedélyezték, akkor a készítmény minden EU országban forgalomba helyezhető, alkalmazható. Így, amikor decemberben a Pfizer Comirnatiy nevű COVID-19 elleni mRNS vakcináról az Európai Gyógyszer Ügynökség kiadta a feltételes forgalomba hozatali engedélyt, az a készítmény magyarországi alkalmazásának is utat nyitott. (3)
- Uniós tagságunk e tekintetben tehát lerövidítheti a COVID-19 elleni vakcináció tömeges alkalmazását?
- A válasz egyértelmű: igen.
- Ha egy vakcina nem az uniós forrásokon keresztül érkezik Magyarországra, hogyan történik az engedélyezés?
- A Gyógyszertörvény, a módosított 52/2005. (XI. 18.) EüM r. az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról szóló rendeletnek, valamint a 488/2020. (XI. 11.) sz. és az azt módosító 19/2021. (II. 28.) sz, - a biztonságos veszélyhelyzeti gyógyszerellátáshoz szükséges egyes intézkedésekről szóló kormány-rendeletnek megfelelően az engedélyezés nemzeti hatáskörben történik. A lehetőségeket az alábbi ábra szemlélteti.
Az Európai Unió eddig az un. új generációs, valamint a vírus vektor alapú vakcinákra adott ki forgalomba hozatali engedélyt, a klasszikus technológiával gyártott védőoltások esetében ajánlásai vannak. Ezen készítmények az egyes országok szakhatóságainak engedélyezési hatáskörében vannak utalva. Ha ez megtörténik, az Európai Unió szakhatósága is befogadhatja, engedélyezheti azt.
EU jogrendje (726/2004 rendelet 3.2. §) szerint
„A Közösség e rendelet rendelkezéseinek megfelelően a mellékletben nem említett gyógyszer vonatkozásában is adhat ki forgalomba hozatali engedélyt, ha:
a) a gyógyszer olyan új hatóanyagot tartalmaz, amely e rendelet hatálybalépésének napján a Közösségben nem volt engedélyezve; vagy
b) a kérelmező igazolja, hogy a gyógyszer jelentős terápiás, tudományos vagy technikai innovációt képvisel, vagy hogy az engedély e rendeletnek megfelelő megadása közösségi szinten a betegek vagy az állategészségügy érdekeit szolgálja.”
Az EMA 2020. novemberi közleménye szerint, - szoros együttműködésben a nemzeti kompetens hatóságok tudományos bizottságainak szakértőivel - gyorsított eljárást alkalmaz majd e folyamat időtartamának lerövidítésére. A cél a magas minőségű kérelmek lehető legrövidebb időn belül történő értékelése, a tudományos vélemények komoly megalapozottságával. Ezért a COVID-19 vakcinák forgalomba hozatali kérelmeit központi eljárás keretében értékelik. Ezen túlmenően az EMA tudományos mechanizmusait használják, amikor csak szükséges, a fejlesztést végző szervezetek felé irányuló tanácsadás - a minőség, a biztonságosság és a hatásosság követelményeivel kapcsolatban -, amelyeket a gyógyszer EU piacra kerülése érdekében teljesíteni kell. (4)
II. A vakcina alkalmazását korlátozó tényezők
- A jelenleg alkalmazott vakcinák esetében vannak korhatárt illető határok, vagy egyéb, az alkalmazást korlátozó tényezők, veszélyek?
- A hivatalos lakossági tájékoztatás szerint a PFIZER/BIONTECH által gyártott Comirnaty COVID-19 elleni mRNS vakcina jelenleg a várandós vagy szoptató nőknek, illetve a gyermekeknek nem javasolt. (5)
- Az EMA a Moderna Biotech készítménye, a COVID-19 vakcina Moderna esetében megadta a feltételes forgalomba hozatali engedélyt. A vakcina jelenleg gyermekek számára nem ajánlja az oltást, de az EMA megállapodott a céggel a gyermekekkel kapcsolatos kísérletek későbbi lefolytatásának tervéről.
Az oltás terhes nőknél történő alkalmazásáról az egészségügyi szakemberrel folytatott szoros konzultáció után kell meghozni a döntést az előnyök és kockázatok mérlegelését követően. Részletes információk az OGYÉI honlapján olvashatóak. (6)
helpNeT szerkesztőségi cikk - olvasói kérdéseket ide kattintva lehet feltenni!
Hivatkozások
(1) Koronavírus oltásokról általánosságban - https://koronavirus-kisokos.eu/posts/182/
(2) Dr. Zelkó Romána: Gyógyszerek és gyógyszertárban forgalmazható termékek forgalomba hozatala https://semmelweis.hu/gyogyszertar/files/2020/03/Zelko-Gy.Ism-20200302.pdf
(3) Az EMA az első COVID-19 vakcinát javasolja engedélyeztetésre az EU-ban https://www.ema.europa.eu/en/news/ema-recommends-first-covid-19-vaccine-authorisation-eu
(4) HMA*/EMA**közlemény a vakcinák engedélyezéséről 2020 november 20. (Dr. Dobson Szabolcs gyógyszer-engedélyezési szakértő fordítása)
(5) LAKOSSÁGI TÁJÉKOZTATÓ A PFIZER/BIONTECH ÁLTAL GYÁRTOTT COMIRNATY COVID-19 ELLENI mRNS VAKCINÁRÓL
(6) Az Európai Gyógyszerügynökség a Moderna oltóanyagának (COVID-19 Vakcina Moderna) forgalomba hozatalát ajánlja az EU-ban - 2021.01.07. https://ogyei.gov.hu/az_europai_gyogyszerugynokseg_a_moderna_oltoanyaganak_covid_19_vakcina_moderna_forgalomba_hozatalat_ajanlja_az_eu_ban___20210107